Selama siklus siklus panjang, kapasitas reversibel baterai lithium-ion akan terus menurun karena pengurangan bahan aktif, pengendapan logam lithium, konsumsi elektrolit yang terus menerus, peningkatan resistansi internal dan pelarian termal. Di antara mereka, fenomena evolusi lithium dari elektroda negatif grafit adalah penyebab paling penting dari penurunan kapasitas baterai dan korsleting internal.
Melanjutkan artikel teknis terakhir kami, sekarang kami akan menjelaskan lebih lanjut tentang fenomena ini di bawah ini:
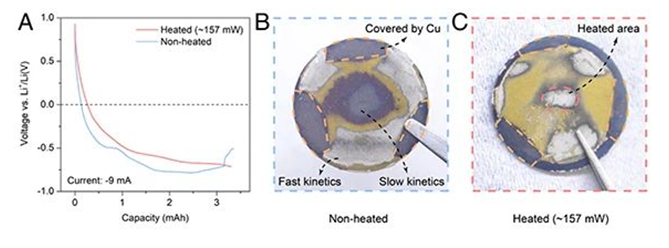
Berdasarkan studi baterai Li-Cu, penulis berharap dapat membuktikan bahwa baterai Li-grafit juga dapat mengalami reaksi evolusi lithium pada potensial lebih tinggi dari 0 V (vs Li0/Li+). Untuk meminimalkan efek kinetika, para peneliti mengurangi arus konstan yang diterapkan menjadi -10 mA (kira-kira C/25). Tiga platform tegangan pada Gambar 4B sesuai dengan tahap penyisipan lithium yang berbeda dari grafit. Pada tahap terakhir dari platform tegangan ketiga, perangkat pemanas dihidupkan (Gambar 4C), dan tegangan baterai meningkat dengan cepat karena peningkatan potensial elektroda keseimbangan dan pengurangan potensial. Kemudian ketika reaksi interkalasi lithium grafit berlanjut, tegangan mulai turun. Ketika tegangan turun menjadi 25 mV, kemiringan kurva tegangan turun secara signifikan (seperti yang ditunjukkan pada Gambar 4E), yang sama sekali berbeda dari kurva pengisian grafit yang tidak dipanaskan, yang dapat berarti bahwa ion litium mulai mengendap dan mengendapkan logam litium. Ketika tegangan turun menjadi 15 mV, arus yang diberikan dihilangkan (panah abu-abu pada Gambar 4B). Pada saat ini, tegangan tiba-tiba meningkat menjadi 72 mV karena peningkatan konsentrasi ion lithium antara partikel grafit dan dalam elektrolit. Hal ini disebabkan oleh pelarutan litium dan interkalasi litium lebih lanjut pada bagian interkalasi yang tidak sempurna antar lapisan grafit. Setelah tegangan stabil menjadi 85 mV, arus konstan diterapkan kembali untuk jangka waktu tertentu dan kemudian dihapus lagi, secara siklis. Selama seluruh proses, potensi elektroda grafit selalu tetap di atas 0 V (vs Li0/Li+). Dapat dilihat dari kurva suhu pada Gambar 4D bahwa tren perubahan suhu sistem sangat mirip dengan elektroda Li-Cu. Alasan penurunan suhu adalah disipasi panas yang disebabkan oleh pengendapan logam lithium. Ketika arus yang diberikan dihilangkan, pembubaran dan interkalasi lithium lebih lanjut di antara lapisan grafit membuat suhu baterai naik. Setelah percobaan, pengendapan litium logam juga dapat dilihat di area tengah potongan tiang grafit, mengkonfirmasikan bahwa distribusi suhu yang tidak merata di dalam pembubaran dan interkalasi lithium lebih lanjut antara lapisan grafit membuat suhu baterai naik. Setelah percobaan, pengendapan litium logam juga dapat dilihat di area tengah potongan tiang grafit, mengkonfirmasikan bahwa distribusi suhu yang tidak merata di dalam pembubaran dan interkalasi lithium lebih lanjut antara lapisan grafit membuat suhu baterai naik. Setelah percobaan, pengendapan litium logam juga dapat dilihat di area tengah potongan tiang grafit, mengkonfirmasikan bahwa distribusi suhu yang tidak merata di dalam baterai memang dapat menyebabkan anoda grafit mengalami pengendapan litium pada potensi reaksi yang lebih tinggi dari 0 V (vs. Li0/Li+).
Gambar 5. Evolusi litium pada anoda grafit dalam kondisi pengisian cepat
(c) Dalam kondisi pemanasan, foto elektroda negatif grafit setelah pengisian cepat, area pusat sepenuhnya diselingi dengan lithium dan fenomena evolusi lithium terjadi.
Kategori
terkini postingan
Pindai ke wechat:everexceed
